Forschung
Molekulare Pinzetten und Klammern gegen pathologische Proteinaggregation
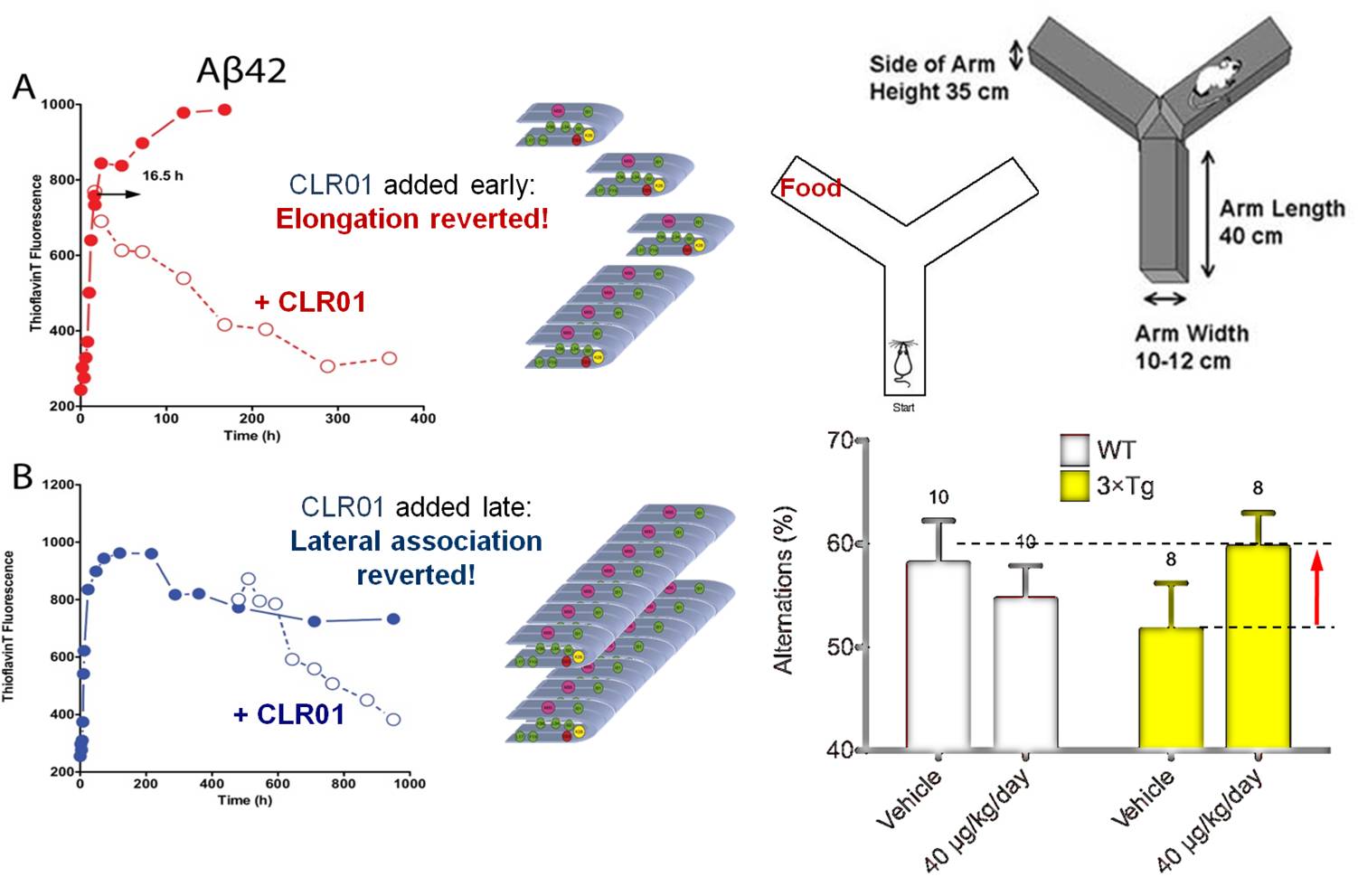
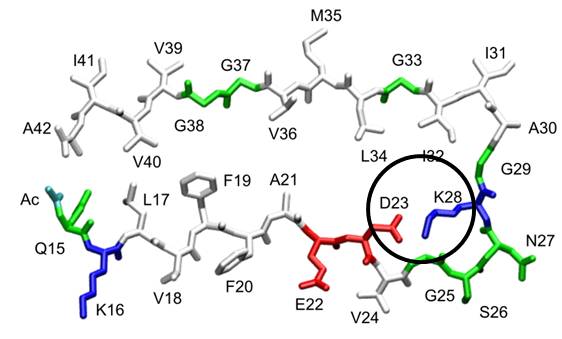
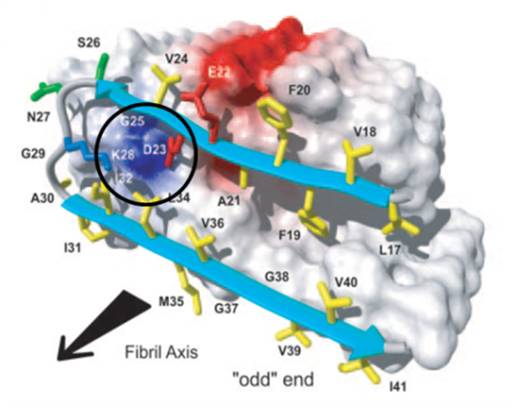
Bei der Fehlfaltung zahlreicher Peptide und Proteine sind kritische Lysinreste beteiligt: so bildet das Alzheimer-Peptid erst durch eine Salzbrücke zwischen Asp-23 und Lys-28 seine U-förmige Konformation, welche zur Umfaltung und anschließenden lateralen Anlagerung weiterer Peptidmoleküle zu Oligomeren bis hin zu Fibrillen führt. In enger Kooperation mit der Gruppe von G. Bitan (Neurologie, UCLA) wird der Einfluss die Pinzette auf die pathologische Proteinfaltung untersucht.
Eine Komplexierung mit der Pinzette belegt selektiv die Lysin- und Argininreste und verhindert die Umfaltung zum β-Faltblatt (CD). Zahlreiche biophysikalische Experimente belegen, dass keine toxischen Aβ-Oligomere und Fibrillen mehr gebildet werden, sondern dass stattdessen amorphe nichttoxische Aggregate entstehen. Die Viabilität von Nervenzellen wird nach Schädigung vollständig wiederhergestellt und elektrophysiologische Studien demonstrieren dasselbe für miniexcitatory postsynaptic currents (mepsc) und die Long Term Potentiation (LTP). Dreifach transgene Mäuse bilden kaum noch anfärbbare Ablagerungen im Cortex, und erste Verhaltensstudien verliefen erfolgreich (Y-Maze-Test).
Auch gegen die pathologische Aggregation von α-Synuclein (Parkinson) wirkt die molekulare Pinzette; so verhindert sie in 10 µM Konzentration im Wasser fast vollständig die Missbildung und den vorzeitigen Tod von transgenen Zebrafischen. Eine erstaunliche katalytische Effizienz entwickelt die Phosphatpinzette gegenüber der pathologischen Aggregation von Islet Amyloid Precursor Peptid (Diabetes mellitus II). So wird die Ausbildung von unlöslichen β-Faltblättern des extrem aggregationsfreudigen IAPP noch bei einem millionenfachen Unterschuss and Pinzette wirksam gehemmt (ThT, TEM).
Durch Kollaborationen mit neurobiologischen Arbeitskreisen weltweit werden gegenwärtig weitere Einsatzfelder der molekularen Lysin- und Argininpinzette erschlossen. Auch hier synthetisieren wir weiterentwickelte Prototypen mit erhöhter Protein-Selektivität und Affinität. Mit ihrer Hilfe werden Mechanismen der Proteinfehlfaltung untersucht und mögliche krankheits-modizierende Therapiewege erprobt.
Literatur:
- Lysine-specific molecular tweezers are broad-spectrum inhibitors of assembly and toxicity of amyloid proteins. S. Sinha, D. H. J. Lopes, Z. Du, E. S. Pang, A. Shanmugam, A. Lomakin, P. Talbiersky, A. Tennstaedt, K. McDaniel, R. Bakshi, P.-Y. Kuo, M. Ehrmann, G B. Benedek, J. A. Loo, F.-G. Klärner, T. Schrader, C. Wang, G. Bitan, J. Am. Chem. Soc. 2011, 133, 16958-16969.
- A Novel “Molecular Tweezer” Inhibitor of a-Synuclein Neurotoxicity in Vitro and in Vivo. S. Prabhudesai, S. Sinha, A. Kotagiri, A. Fitzmaurice, F.-G. Klärner, T. Schrader, G. Bitan, J. M. Bronstein, Neurotherapeutics 2012, 9, 464-476.
- Protection of primary neurons and mouse brain from Alzheimer’s pathology by molecular tweezers. A. Attar, C. Ripoli, P. Maiti, S. Sinha; T. Liu, M. R. Jones; F. Yang, G. D. Gale, K. Lichti-Kaiser, C. Tseng, M. Tan, C.-W. Xie,J. L. Straudinger, F.-G. Klärner, T. Schrader, S. A. Frautschy, C. Grassi, G. Bitan, Brain2012, 135, 3735-3748.