Forschung
Maßgeschneiderte Polymere zur Erkennung von Proteinoberflächen:
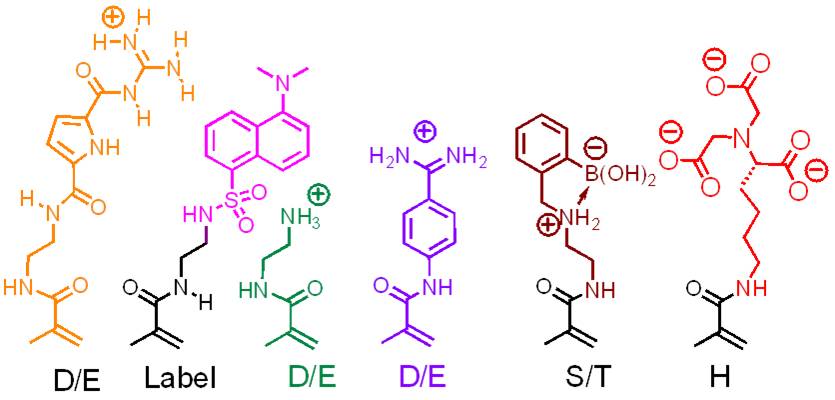
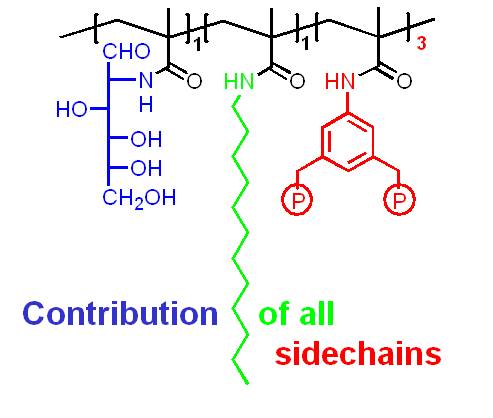
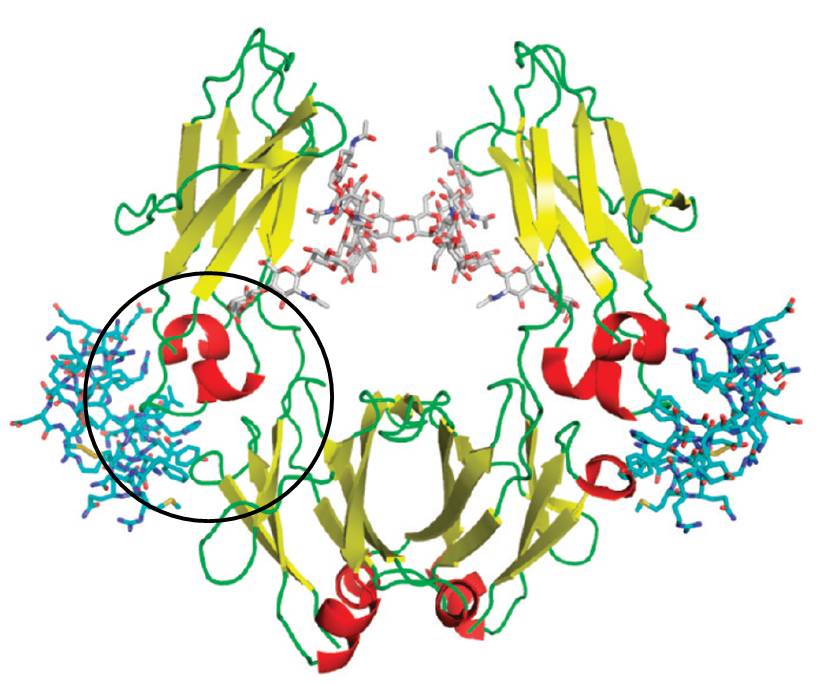
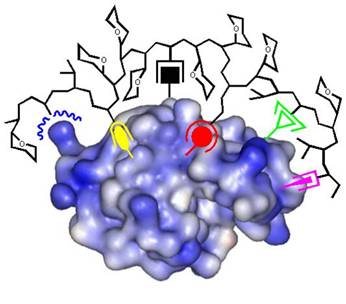
Die molekulare Erkennung größerer Bereiche auf Proteinoberflächen durch künstliche Moleküle stellt große Anforderungen: hier sind ausgedehnte Molekülgerüste gefragt, die unterschiedliche Haftgruppen in physiologischer Lösung so präsentieren können, dass sie die spezifische Anordnung unterschiedlicher Aminosäurereste chemisch und topologisch abtasten. Eine relativ einfache Lösung ist die Synthese von Monomerbausteinen mit Aminosäureselektivität und ihre Copolymerisation in wässriger Lösung. Wir haben dieses Konzept vor einigen Jahren eingeführt und damit begonnen, einen stetig wachsenden Pool an Methacrylsäureamiden aufzubauen, von denen jedes eine Aminosäure(klasse) bevorzugt. Ihre radikalische Copolymerisation in Wasser/DMF-Gemischen führt in hohen Ausbeuten zu linearen, wasserlöslichen, fluoreszierenden Polymeren.
Werden die richtigen Monomerbausteine im richtigen Molverhältnis zueinander eingesetzt, sind die resultierenden Polymere in der Lage, ihr Zielprotein mit überraschender Selektivität und Affinität zu binden (Lysozym: Cytochrom C = 100:1; Kd ~ 25 nM). Dabei können Enzymeigenschaften komplett abgeschaltet und durch nachträgliche Gabe von noch stärkeren Polymerbindern wieder angeschaltet werden.
In Zusammenarbeit mit der Gruppe von H. de Groot entwickeln wir gegenwärtig selektive Hemmstoffe für Verdauungsenzyme zum Einsatz bei Darmischämie; in Kollaboration mit M. Ulbricht (UDE) und B. Sellergren (Univ. Dortmund) entstehen neue Affinitätspolymere und Capture-Phasen für medizinische Antikörper.
Literatur
- Arginine- and Lysine-Specific Polymers for Protein Recognition and Immobilization. C. Renner, J. Piehler, T. Schrader, J. Am. Chem. Soc. 2006, 128, 620-628.
- Tuning Linear Copolymers into Protein-Specific Hosts. S. Koch, C. Renner, X. Xie, T. Schrader, Angew. Chem. Int. Ed. 2006, 45, 6352-55.
- A Noncovalent Switch for Lysozyme. K. Wenck, T. Schrader, J. Am. Chem. Soc. 2007, 129, 16015-16019.