Biochemie und Physiologie

Eine Vielzahl der am ZKM von T. tenax beteiligten Proteine (ca. 22; z.T. in Zusammenarbeit mit R. Hensel) sowie weitere Enzyme anderer hyperthermophiler Archaea konnten entweder mittels klassischer oder neuer Genom-basierter Methoden identifiziert werden. Die heterologe Expression erfolgte in Escherichia coli. Nach Aufreinigung der rekombinanten Proteine konnten die vorhergesagten Aktivitäten mittels enzymatischer Studien bestätigt werden [6-10, 13, 17, 20,23, 25, 26].
Das Ziel dieser detaillierten biochemischen/molekularbiologischen Untersuchungen ist es, die Regulation der Stoffwechselwege bzw. der beteiligten Enzyme auf Protein- und Genebene zu verstehen. Durch diese Arbeiten soll ein Beitrag zur Entschlüsselung der physiologischen Rolle und der Integration in das zelluläre Netzwerk geleistet werden.
Neben physiologischen Studien sind auch phylogenetische Aspekte (Zusammenarbeit mit H. Brinkmann) und die Aufklärung von Proteinstrukturen und Reaktionsmechanismen (Zusammenarbeit mit E. Pohl) von besonderer Bedeutung für unsere Arbeiten. Diese kombinierte Vorgehensweise wurde z.B. bei der „archaeal type Class I fructose1,6-bisphosphate aldolase" [12, 14, 16, 19] und der KD(P)G Aldolase [20, 27] angewandt. 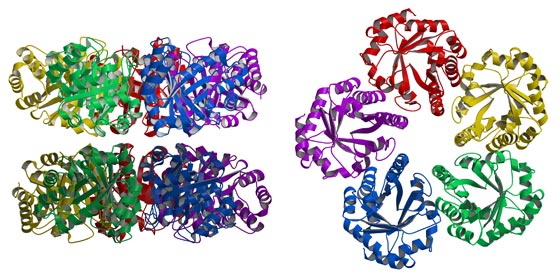
Fructose-1,6-bisphosphate Aldolase (archaeal-type, Class I) Thermoproteus tenax [12, 14, 16, 19].
